Olá jovens!
Em nossa primeira aula discutimos os aspectos gerais da matéria, e esse post é sobre isso (e mais algumas coisas pertinentes).
O que veremos neste post:
– Propriedades gerais da matéria
– Propriedades específicas da matéria
– Formas de agregação da matéria
– Mudanças de fase de agregação
– Substâncias e misturas
– Gráficos de mudança de fase
– Diagrama de fases
– Alotropia
– Alguns tipos de água
Se nosso estudo é sobre a matéria, precisamos entender o que significa isso, certo? Então vamos lá, matéria é tudo aquilo que possui massa e ocupa espaço (portanto tem volume) e podemos usar alguns termos para “subdividi-la”: 1°) Corpo: porção limitada da matéria, por exemplo uma pedra; 2°) Objeto: corpo produzido para utilização, como exemplo temos o lápis, o celular, etc. Essas subdivisões não são tão importantes para nosso curso, mas é bom saber os termos.
Propriedades gerais da matéria
A matéria como um todo possui algumas propriedades, independente do que seja constituída essa matéria, e é importante conhecermos algumas:
- Massa
- Volume
- Impenetrabilidade: é a famosa máxima “dois corpos não podem ocupar o mesmo lugar no espaço ao mesmo tempo”
- Elasticidade: é a capacidade de um corpo ou sistema de retornar à sua forma original após ser deformado por uma força. Todos os objetos possuem elasticidade, seja ela alta ou baixa
Propriedades específica da matéria
As propriedades específicas da matéria diferenciam os tipos de matéria que temos, os tipos de materiais (como por exemplo diferenciar vidro e madeira, ou mesmo água no estado líquido ou gasoso). São elas:
- Ponto de fusão: temperatura na qual uma substância muda do estado sólido para o líquido. A temperatura de fusão da água, em graus Celsius e a 1 atm, é de 0°
- Ponto de ebulição: temperatura na qual uma substância muda do estado líquido para o gasoso. A temperatura de ebulição do etanol é de aproximadamente 78°
- Densidade: é a razão entre a massa e o volume do material (a uma dada temperatura). Ou seja, é a quantidade de matéria (em massa) que ocupa um determinado espaço (volume): d=m/V, sendo a massa dada em quilogramas (kg) e o volume em metros cúbicos (m3) no Sistema Internacional. Mas comumente usamos a grama por centímetro cúbico (g/cm3 ou g · cm-3) ou grama por mililitro (g/mL ou g · mL-1). Quando dois ou mais líquidos estão em contato e não se misturam, é possível, em geral, determinar qual é mais denso, porque o líquido menos denso flutua, fica na parte de cima, como é possível ver nessa coluna de água (d = 1 g/cm3) e de óleo (d ≈ 0,8 g/cm3) – Ainda estudaremos os motivos disso

fonte: https://escolakids.uol.com.br/ciencias/como-o-sabao-funciona.htm
- Propriedades organolépticas: embora não muito discutidas nos cursos em geral, são as características de uma substância que podem ser percebidas e avaliadas pelos cinco sentidos humanos (visão, olfato, paladar, tato e audição), como cor, cheiro, sabor, textura e som. É claro que para o curso de química não iremos provar uma porção da matéria para saber do que se trata (imagina que delícia beber ácido sulfúrico)
Formas de agregação da matéria
As formas de agregação indicam como a matéria pode se apresentar, e que podem ser diferenciadas a partir de algumas características como forma e volume.
Pense por exemplo na água em estado sólido (gelo). Quando se coloca gelo no copo, ele não toma a forma do copo, mantendo sua forma, e também não muda seu volume. Em termos submicroscópicos, as moléculas de H2O estão interagindo fortemente umas com as outras, com pequenas distâncias entre elas. Já na água líquida, caso você coloque-a num copo, ela tomará a forma dele, tendo sua forma variável, mas seu volume permanece constante (um litro de água numa jarra ao ser derramado no chão ainda é 1 litro, mesmo que esteja mais espaçado). E por fim, no estado gasoso as partículas estão muito afastadas, dispersas no espaço, ocasionando pouca interação entre elas, logo, possuindo forma variável e volume também (é possível, por exemplo, diminuir o volume de uma bola de futebol cheia de ar sem diminuir a quantidade de ar presente nela). Além disso, existem duas propriedades importantes para os gases, a primeira já comentada: compressibilidade (volume variável) e a segunda, os efeitos de efusão e difusão. A efusão é a capacidade que um gás tem por escapar por um pequena orifício (pense num pneu com pequeno furo) e difusão é a capacidade de se espalhar (imagine que se você abrir um perfume em uma sala, logo ela ficará toda com o cheiro)
Aqui há um quadro que resume o que foi dito sobre os estados de agregação:
| Estado | Partículas | Agitação térmica | Forma | Volume |
| Sólido | Muito juntas | Mínima | Fixa | Fixo |
| Líquido | Juntas | Intermediária | Variável | Fixo |
| Gasoso | Separadas | Máxima | Variável | Variável |
Fonte: Elaboração própria
A imagem abaixo também ajuda a organizar o pensamento:
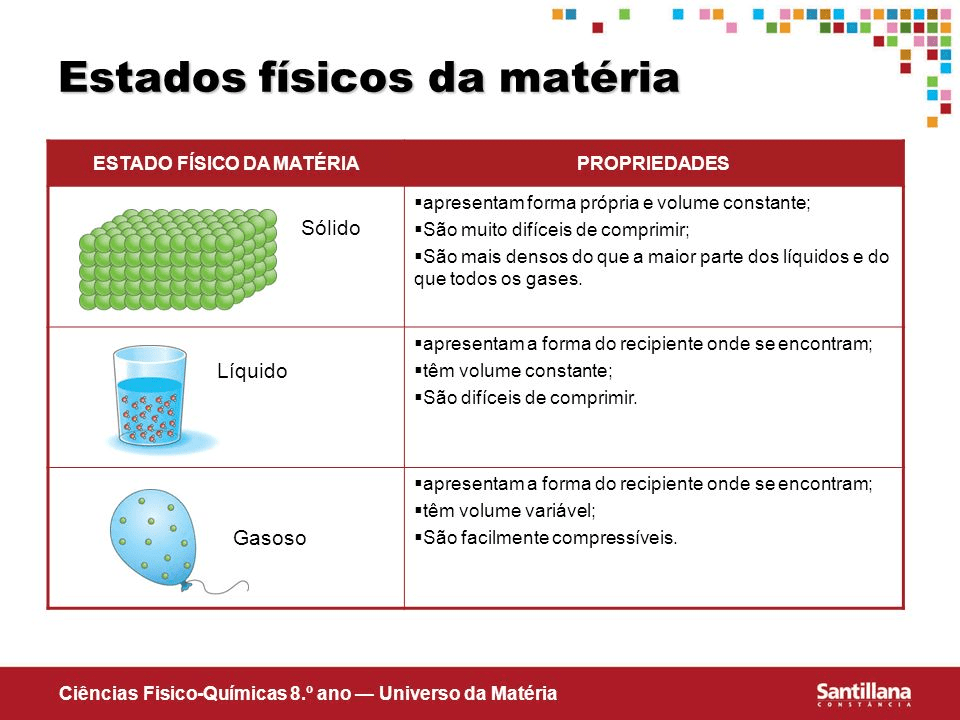
Fonte: https://estudosdeanaluisa.wordpress.com/2015/07/02/cienciasos-estados-fisicos-da-materia/
Mudanças de fase de agregação
As substâncias podem sofrer mudança de estado físico, desde que haja uma variação de temperatura e/ou pressão.
Para que exista a mudança de fase é preciso que a substância receba energia (transformação endotérmica) ou que libere energia (transformação exotérmica). A imagem abaixo resume os processos (da direita para a esquerda – em rosa – a água recebe energia, e da direita para a esquerda – em verde – a água libera energia)
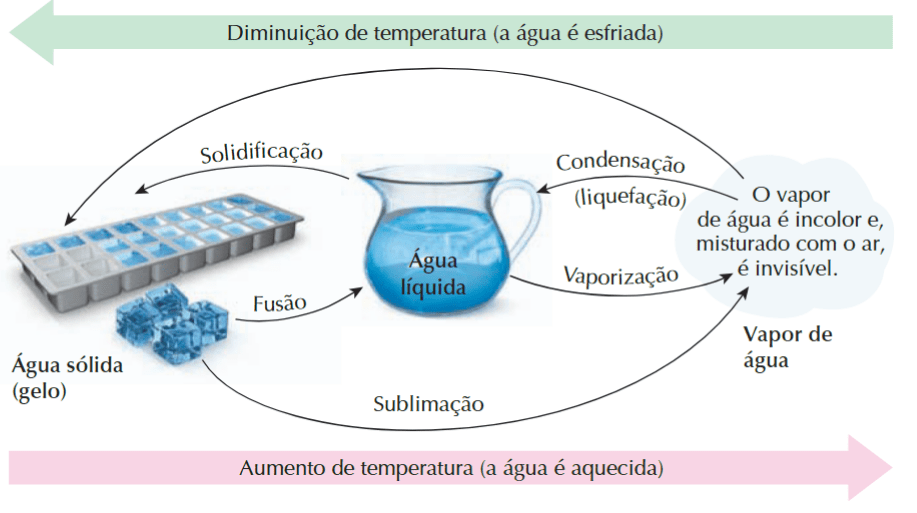
Fonte: TITO, A.; CANTO, D. L. de. Química na abordagem do cotidiano. 5. ed. São Paulo: Editora Moderna, 2009.
- 1°) Evaporação: passagem lenta e natural, ocorrendo em qualquer temperatura que haja líquido e sem a formação de bolhas. Exemplo: a roupa secando no varal.
- 2°) Ebulição: passagem rápida e turbulenta, ocorre em uma temperatura determinada (como comentado no começo do post) e há formação de bolhas. Exemplo: água em fogo alto. As bolhas formadas nada mais são do que a água que passou do estado líquido para o gasoso (imagine que como o fundo da panela que está em contato com o fogo, a água do fundo vai ebulir primeiro)
- 3°) Calefação: processo imediato, ocorre por conta de choque térmico. Exemplo: quando se coloca água em uma chapa quente.
- Diversos fenômenos podem ser entendidos a partir das mudanças do estado de agregação. Como citado em sala a termorregulação corporal (famoso suor), o ventilador, os potes de barro e o cozimento de alimentos em panela de pressão. No caso do funcionamento da panela de pressão a ideia é relativamente simples. Todos nós estamos sujeitos a pressão atmosférica, que é a pressão que a coluna de ar em cima de nós exerce, e essa pressão dificulta que as partículas se “libertem” umas das outras, fazendo com que o ponto de ebulição (passagem do estado líquido para o gasoso) seja maior quanto maior for a coluna. Veja a imagem abaixo
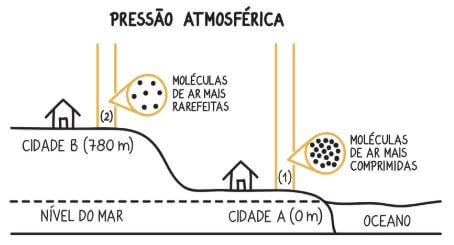
fonte: https://resumos.mesalva.com/atmosfera-pressao-altitude-temperatura/
Agora imagine que você coloque água no fogo no nível do mar, na imagem a cidade A, a 0 m (a altitude é medida de baixo para cima). A água ferverá a 100°C, dado que essa é a altura padrão. Mas se você colocar na cidade B, que está a 780m do nível do mar, o que espera que aconteça?
Nesse caso o ponto de ebulição da água será menor que 100°C, ou seja a água entrará em ebulição a um valor menor. Como comentado, isso se deve ao tamanho da coluna de ar em cima da água, que por ser menor fará uma pressão menor. Agora parece simples entender a panela de pressão. Por ela ser um sistema fechado, ao aumentar a temperatura dentro dela, as moléculas aumentarão sua agitação e terão mais velocidade, fazendo com que os choques entre o líquido e as paredes da panela fiquem mais rápidos, o que acarreta num aumento de pressão, e com o aumento da pressão a água ferverá a mais de 100°C, ou seja o alimento será cozido numa temperatura superior a 100°C que dependerá do fogo utilizado.
Substâncias e misturas
Como dito no começo do post, matéria é tudo aquilo que tem massa e ocupa espaço, podendo ser encontrada no estado sólido, líquido ou gasoso. A matéria é composta por átomos (estudaremos logo logo os modelos atômicos). Ao separar uma porção da matéria para estudar teremos o que denomina sistema. Os sistemas podem ser classificados de duas maneiras:
1°) Quanto à constituição (composição): substância pura ou mistura;
2°) Quanto ao aspecto “visual” (não usamos apenas a visão humana para análise): homogêneo ou heterogêneo.
Os dois critérios não se excluem. Uma substância pode ser pura e homogênea, bem como pura e heterogênea, mistura homogênea ou mistura heterogênea.
Vamos às definições.
- Substância pura: é constituída por moléculas quimicamente iguais e possui composição definida. Além disso, uma importante característica é que possuem pontos de fusão e ebulição constantes. As substâncias puras são classificadas como simples ou compostas; Para as substâncias simples há apenas um elemento químico, ou seja, um único tipo de átomo, independente da quantidade (Exemplo: Oxigênio (O2), Ozônio (O3), Nitrogênio (N2) e Cloro (Cl2). Já as substâncias puras compostas são constituídas por dois ou mais átomos, independentemente da quantidade (Exemplo: água (H2O), ácido sulfúrico (H2SO4), gas carbônico (CO2) e glicose (C6H12O6).
- Mistura: é sempre constituída por duas ou mais substâncias puras misturadas (como o nome sugere) e apresenta composição variada. As misturas podem ser classificadas como homogêneas (apresentam apenas uma fase) ou heterogêneas (apresentam duas ou mais fases). Pode parecer confuso mas a imagem abaixo ajuda
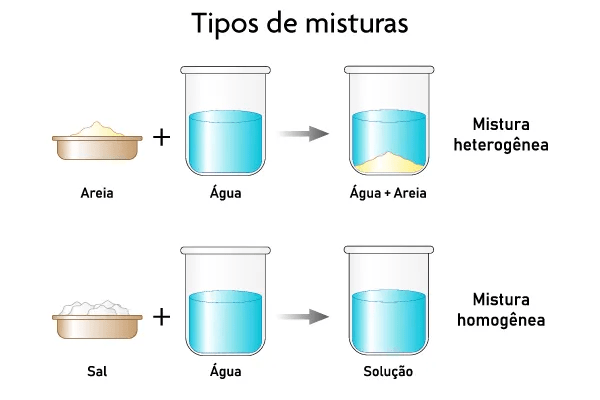
Fonte: https://brasilescola.uol.com.br/quimica/tipos-misturas.htm
No caso das misturas é importante destacar que em geral elas podem ser separadas por processos físicos, por exemplo na água com sal pode-se aquecer o sistema para que a água evapore, restando apenas o sal no fundo do recipiente.
Em geral, segue um esquema útil (não há diferenciação entre substância pura simples e composta):
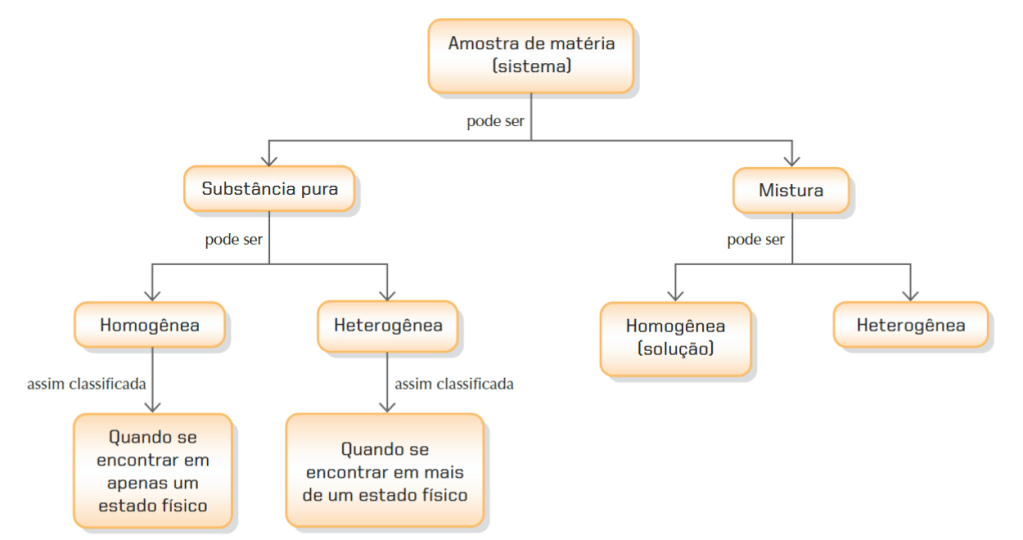
Fonte: TITO, A.; CANTO, D. L. de. Química na abordagem do cotidiano. 5. ed. São Paulo: Editora Moderna, 2009.
Gráficos de mudança de fase
A matéria passa por mudanças na fase de agregação, como já estudamos, mas isso depende do tipo de sistema que estamos estudando.
– Substâncias puras: no caso de substâncias puras, os pontos de fusão e ebulição são constantes, podendo ser entendidos graficamente. Para que uma substância saia do estado sólido para o líquido é preciso que ela receba calor (Q) e isso fará, num primeiro momento, com que ela aumente sua temperatura. Esse aumento de temperatura, ou seja da agitação das moléculas presentes no sólido, faz com que as moléculas comecem a interagir menos, até que chega um ponto em que, enquanto se está cedendo calor para o sistema, a temperatura não aumenta mais, pois a energia recebida pelo sistema é usada para romper as interações entre as moléculas, fazendo com que exista ao mesmo tempo sólido e líquido. Após um certo tempo só restará líquido, e a partir daí a temperatura volta a aumentar novamente até chegar no limiar em que começa a surgir gás, como na imagem abaixo
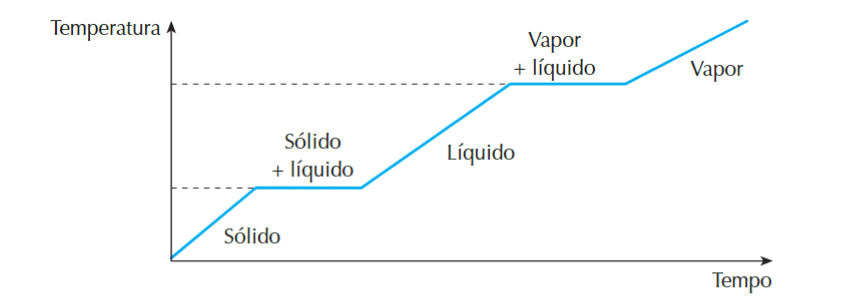
Fonte: TITO, A.; CANTO, D. L. de. Química na abordagem do cotidiano. 5. ed. São Paulo: Editora Moderna, 2009.
– Misturas: no caso das misturas, como existem mais de um componente, os pontos de fusão e ebulição são variáveis, dependendo da composição. A seção do gráfico (faixa de temperatura) em que há a fusão e a ebulição também apresentam dois estados físicos concomitantes (na faixa de fusão sólido e líquido e na faixa de ebulição líquido e gás)
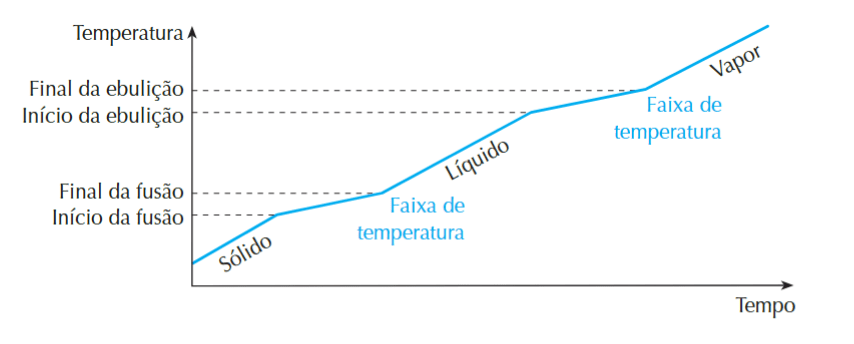
Fonte: TITO, A.; CANTO, D. L. de. Química na abordagem do cotidiano. 5. ed. São Paulo: Editora Moderna, 2009.
Existem, ainda, dois tipos de misturas que possuem gráficos diferentes. São as chamadas misturas eutéticas e as misturas azeotrópicas. Nas misturas eutéticas o ponto de fusão é constante e o de ebulição variável, já nas misturas azeotrópicas possuem ponto de fusão variável e ponto de ebulição constante
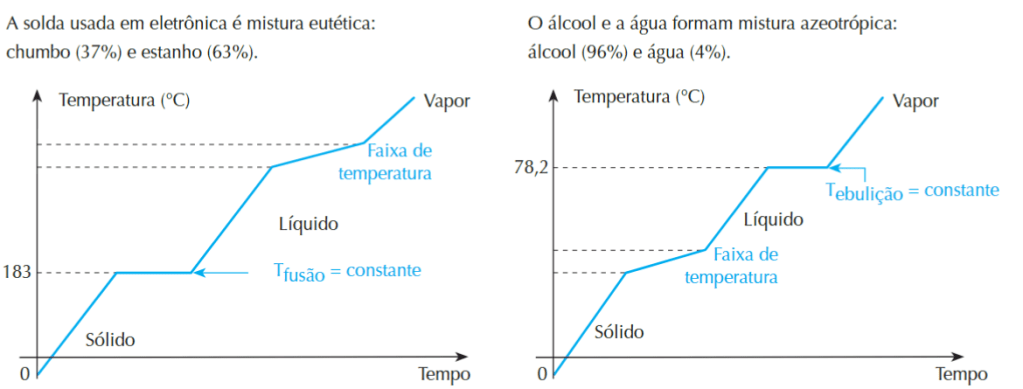
Fonte: TITO, A.; CANTO, D. L. de. Química na abordagem do cotidiano. 5. ed. São Paulo: Editora Moderna, 2009.
Diagrama de fases
O diagrama de fases é um gráfico que permite definir em que estado físico uma substância se encontra num dado instante, conhecendo sua temperatura e pressão. Até agora os gráficos estudados só tinham como base a temperatura.
O diagrama é dividido em três regiões, que representam o estado sólido, líquido e vapor.
Um diagrama de fases apresenta os seguintes elementos:
- Curva de fusão: separa as áreas que correspondem aos estados sólido e líquido;
- Curva de vaporização: separa as áreas que correspondem as fases líquida e vapor
- Curva de sublimação: separa as áreas que correspondem as fases sólida e vapor;
- Ponto triplo: ponto de interseção (encontro) das três curvas (fusão, vaporização e sublimação). Este ponto indica os valores de temperatura e pressão que a substância pode simultaneamente estar nos três estados;
- Ponto crítico: indica a maior temperatura que a substância é vapor. A partir desse ponto não é mais possível diferenciar os estados líquido e vapor. Para temperaturas acima do ponto crítico a substância passa a ser um gás.
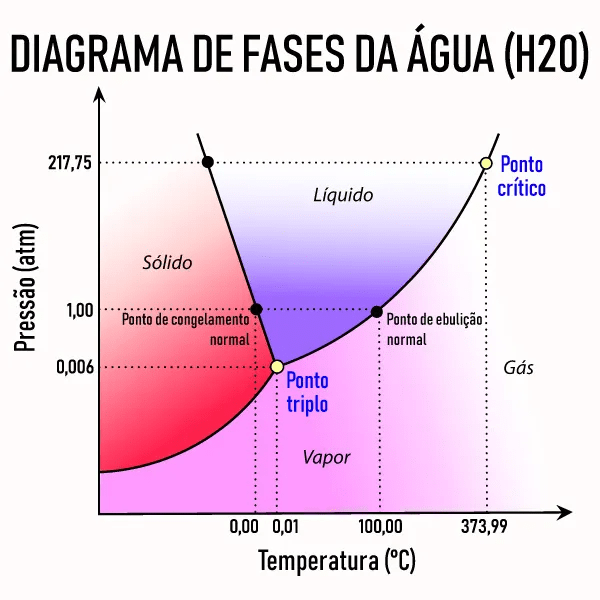
Fonte: https://mundoeducacao.uol.com.br/fisica/diagrama-fases.htm
Alotropia
Alguns elementos químicos possuem a capacidade de formar substâncias simples diferentes, que possuem propriedades distintas. Nesse caso, sempre haverá um estado padrão. Eles podem se diferenciar pela quantidade do átomo ou pelo arranjo espacial.
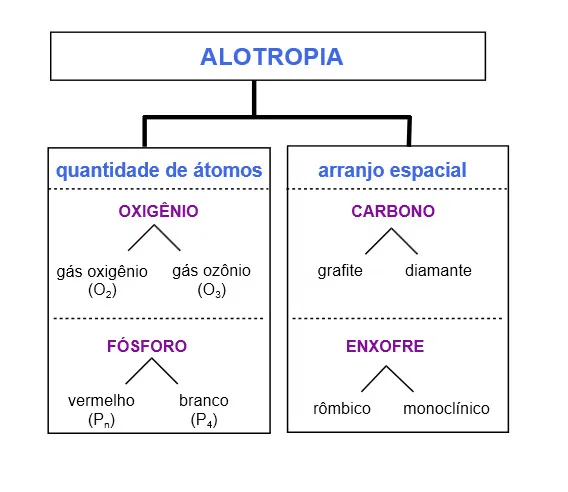
Fonte: https://www.todamateria.com.br/alotropia/
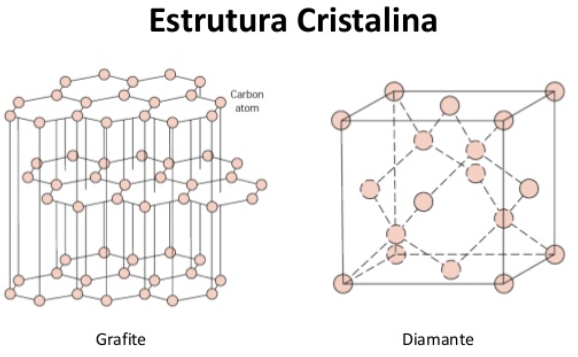
Um caso bem comum é o do carbono. Ele pode ser encontrado na forma de diamante ou grafite, a depender das condições em que se encontra. A diferença é espacial, enquanto o diamante tem um formato tetraédrico, o grafite se conforma a partir de lâminas, o que muda suas características. O Diamante é duro (não é possível riscá-lo) e é isolante elétrico, enquanto o grafite é mole (por isso ao passá-lo em uma folha de papel ele fica no papel) e é um bom condutor de corrente elétrica
Alguns tipos de água
A água possui alguns componentes que influenciam em seu nome, veremos os casos:
1°) Água destilada (ou deionizada): é a água “pura”, que passa por um processo para remoção de minerais, sais, metais presentes naturalmente. Muito usada em laboratórios, hospitais, na indústria
2°) Água mineral: é a água com seus sais naturais, sendo uma mistura homogênea
3°) Água salobra: é uma água com concentração elevada de sal
4°) Água pesada (D2O): é uma água que possui o isótopo deutério, do hidrogênio (ainda estudaremos os isótopos). Usada em reatores nucleares e pesquisas científicas
5) Água dura: é a água com altas concentrações de minerais, sobretudo Cálcio (Ca2+) e Magnésio (Mg2+).
É isso
Terminamos o post passando brevemente por todos os assuntos abordados em sala e alguns mais, em caso de dúvida deixe um comentário ou me procure pessoalmente, valeu galera!

Deixe um comentário